本文屬於資訊與分析性內容,並不構成任何投資建議。
🐣🐣
賀建奎
導言
基因編輯是當代最具革命性的生物醫學技術之一。它使人類得以精確地修改DNA序列,為從根源治療遺傳性疾病、改造免疫細胞以對抗癌症,以及降低慢性病與文明病的遺傳風險開啟了全新道路。
其中最具代表性的系統是 CRISPR–Cas9,該技術於 2020年榮獲諾貝爾化學獎。諾貝爾委員會指出,這項發明「能讓治癒遺傳疾病的夢想成真」 [1]。
自那以後,全球已投入數十億美元的研發資金,誕生了數十家新創公司——他們正努力將這項科學承諾轉化為臨床現實。
到了 2025 年下半年,CRISPR 革命已邁入更成熟的階段:首批基因編輯療法已獲核准並投入臨床應用,患者正真正受益於這項技術 [2][3];同時,更多項目也進入了高階臨床試驗階段——包括鐮刀型貧血(SCD)、β-地中海型貧血(TDT)、轉甲狀腺素蛋白澱粉沉積症(ATTR)、遺傳性血管性水腫(HAE)以及腫瘤治療等領域。
本文將梳理這場革命的技術基礎、里程碑事件、核心企業與商業化現況,重點聚焦於 CRISPR Therapeutics、Intellia Therapeutics 與 Editas Medicine 的進展。
什麼是基因編輯與 CRISPR-Cas9 技術?
基因編輯,是指以極高的精準度對DNA 遺傳物質進行操作—
透過添加、刪除或改變基因片段,來改寫細胞內的遺傳資訊。
基因工程的嘗試已持續數十年,但早期的方法往往成本高昂且操作複雜。真正的突破出現在 2012 年,當時 Jennifer Doudna 與 Emmanuelle Charpentier 成功開發出劃時代的 CRISPR–Cas9 技術。
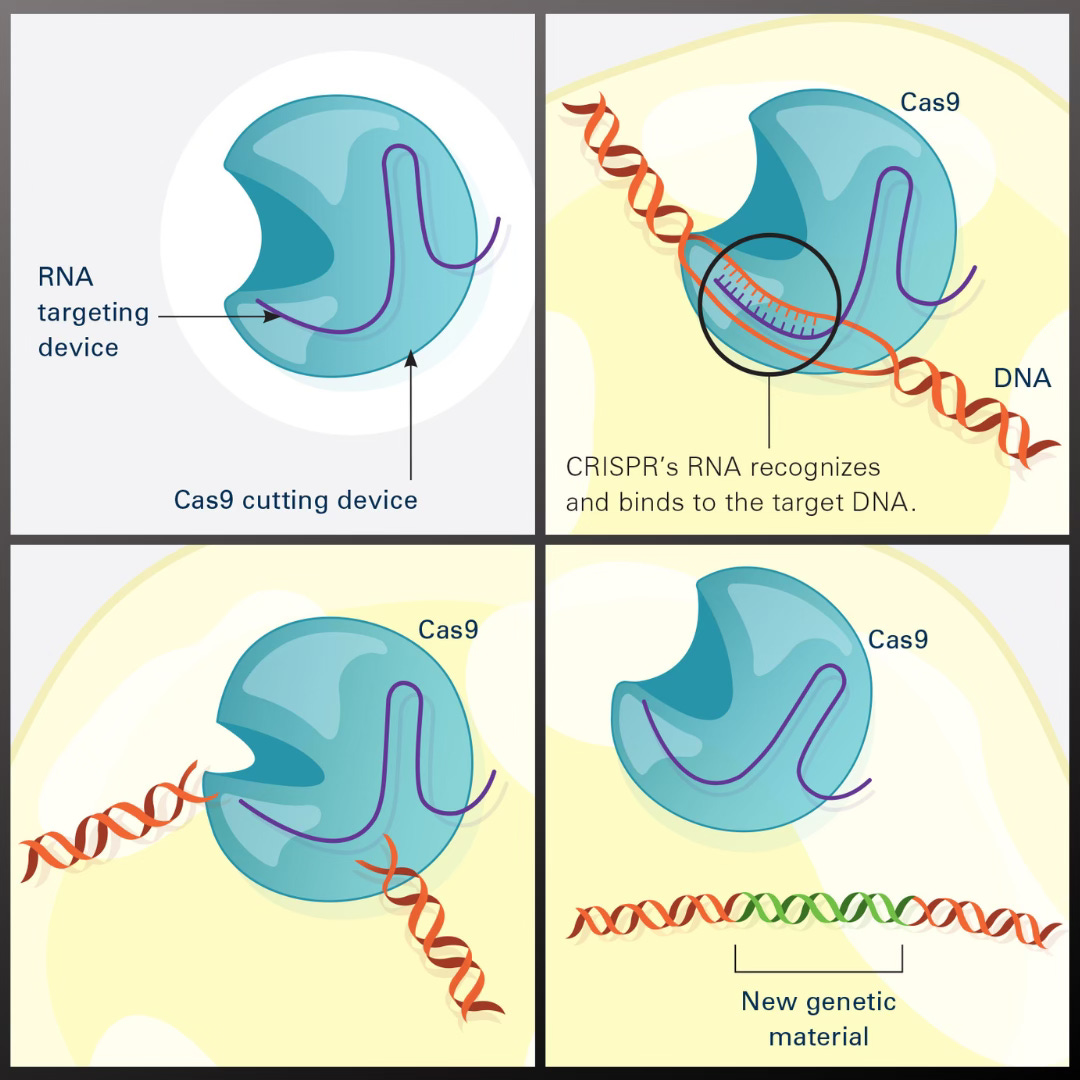
CRISPR–Cas9 的機制源自細菌對抗病毒的天然防禦系統。科學家將這一系統「重新編程」,使其能在 DNA 的特定位點進行切割。實際上,它就像一把具有 GPS 導向功能的分子剪刀——Cas9 酶 負責切割 DNA,而一段與目標基因序列互補的短 RNA 向導則指引它找到準確位置 [4][5]。
當 DNA 的兩條鏈被切斷後,細胞內的天然修復機制隨即啟動,將斷裂的末端重新連接。也正是在這個過程中,研究人員可以導入改變:停用缺陷基因、插入正確序列,或修改特定片段以達到治療目的。
為什麼 CRISPR 會引起如此強烈的反響?
與早期的基因編輯方法——例如鋅指核酸酶(ZFN)或TALEN 系統——相比,CRISPR–Cas9 的出現可謂劃時代的突破:它更簡單、更低成本,而且適用範圍更廣。研究人員只需透過電腦設計一段導向 RNA,即可引導 Cas9 酶到達特定基因,因此全球各地的實驗室都能迅速掌握並應用這項技術。
CRISPR 幾乎能編輯任何生物體內的任意基因——從人類細胞、實驗動物到農作物皆可。
在醫學領域中,它的潛力尤為令人期待:可修復導致遺傳疾病的突變(如鐮刀型貧血、囊性纖維化),也能關閉病毒在體內生存所需的基因(例如 HIV),甚至能重新編程免疫細胞以對抗癌症。
從遺傳根源治癒原本無法治癒的疾病——這一願景使 CRISPR 被譽為革命性的技術。它常被拿來與DNA 結構的發現或抗生素的發明相提並論。
CRISPR–Cas9 並非唯一的基因編輯技術,而是新世代方法的第一代代表。目前,科學界正致力於其升級版——被稱為 CRISPR 2.0 的兩項革新:鹼基編輯(Base Editing)與原始編輯(Prime Editing)。
由 哈佛大學的 David Liu 團隊所開發的鹼基編輯技術,能夠在不切斷 DNA 雙股螺旋的情況下,精確地改變單一「字母」(核苷酸)[8]。這不僅大幅降低潛在風險,也讓研究人員得以糾正點突變所造成的遺傳疾病。
原始編輯(Prime Editing)於 2019 年 首次提出,它將 CRISPR 機制 與 逆轉錄酶(reverse transcriptase) 結合,能夠在基因組內插入、刪除或替換整段 DNA 片段,且精度極高 [9]。此技術被視為目前最具通用性與靈活性的基因編輯工具,因為理論上,它可以在基因組中導入任何類型的改變。
2025 年,研究人員首次在人體上進行 Prime Editing 實驗性應用 [10]。同年 5 月,公司 Prime Medicine 宣佈在一名慢性肉芽腫病(CGD)患者身上取得首個臨床成果。《Nature》期刊將此事件稱為「人類史上首例 Prime Editing 臨床應用」[117]。
技術發展的歷程
雖然 CRISPR 的真正熱潮出現在 21 世紀第二個十年的開端,但「改寫基因」的想法其實歷史更為久遠。早在 1990 年代,人們已開始開發鋅指核酸酶(ZFN),甚至設計出最早的**「分子剪刀」。約在 2011 年,又出現了以細菌 DNA 結合蛋白為基礎的 TALEN 核酸酶。這兩種方法都能奏效,但其設計繁複且成本高昂**,因而限制了醫療應用的推進速度。
真正的突破發生於 2012 年:Emmanuelle Charpentier 與 Jennifer Doudna 發表研究,證明細菌的 CRISPR–Cas9防禦系統可作為精準切割任意 DNA 的通用工具 [1]。同時,Broad Institute 的 Feng Zhang 團隊也獨立推進了類似方向,並在數個月後發表論文。由此掀起了學術競賽與 UC(加州大學) 與 Broad 之間的專利爭議——圍繞著價值數以億計美元的技術權利。最終,雙方各自取得部分專利;今日的生技公司多半向兩者之一取得 CRISPR 授權。這場爭議恰好說明了此項技術的稀缺價值與產業渴求。
在熱情推動下,2013–2015 年湧現了第一批聚焦基因編輯的生技新創:2013 年成立的 Editas Medicine(共同發起者包括 Feng Zhang 與基因體學先驅 George Church);2014 年有 Jennifer Doudna 參與創立的 Intellia Therapeutics;以及由 Emmanuelle Charpentier 在瑞士共同創辦的 CRISPR Therapeutics。這三家公司構成了 CRISPR 產業的第一波,隨後相繼於 NASDAQ 上市,累計募得數以億計美元資金。主流媒體高度關注,《紐約時報》與各大科普節目頻繁報導,市場甚至出現所謂的「CRISPR 狂熱」,外界殷切期盼針對癌症、HIV、遺傳病等的神奇療法能迅速問世。
人體臨床的 CRISPR 嘗試始於 2010 年代中期。2016 年,中國一支腫瘤學團隊將 CRISPR 編輯的 T 細胞輸注給一名肺癌患者——這是開創性且試驗性質的治療,但詳盡結果並未廣泛發表 [13]。
下一步在 2019 年於美國展開:以鐮刀型貧血(SCD)為對象的臨床試驗啟動。研究團隊將患者 Victoria Gray 的骨髓造血幹細胞進行基因編輯,使其生成健康的血紅蛋白;不久後,類似策略也用於β-地中海型貧血(TDT)。同年,Editas 亦啟動遺傳性 Leber 先天性黑朦的首例眼內給藥研究:將載有 CRISPR 的病毒載體直接注入眼內(in vivo)——這是美國首次直接對人體組織進行體內基因編輯。
2020 年,Intellia Therapeutics 更邁出關鍵一步,完成全球首例在患者體內進行的全身性基因編輯。在 NTLA–2001 中,病人以靜脈輸注方式接受脂質奈米顆粒(LNP),其中包覆著編碼 CRISPR 的 mRNA;顆粒進入肝臟後,關閉導致 轉甲狀腺素蛋白澱粉沉積症(ATTR) 的基因——這是一種由異常蛋白沉積引起的致命性疾病。2021 年公告顯示,這項單次療法可讓有害的 TTR 蛋白降低超過 80% [14];此結果被視為重大突破,首次在人類證實全身性 in vivo 基因編輯確具療效。
2023 年 11 月,英國 MHRA 全球首度核准 CRISPR Therapeutics 的 Casgevy 用於 SCD 與 TDT。美國 FDA 隨後於 2023 年 12 月 8 日核准 SCD 適應症,並在 2024 年 1 月 16 日核准 TDT。歐盟亦於 2024 年 2 月 13 日給予有條件核准(適用 12 歲以上患者)。不久之後,Bluebird Bio 的競爭性基因療法 Lyfgenia 也陸續上市 [2][3][116]。
從第一篇關於 CRISPR 的科學論文問世,到今日能拯救生命的療法獲得核准,這段旅程僅用了 十一年。「從實驗室走向臨床批准,只花了十一年,這真是令人驚嘆的成就。」—— Jennifer Doudna 在聽聞 Casgevy 獲批時如此表示 [16]。她同時指出一個極具象徵意義的事實:首個 CRISPR 療法正是用於治療鐮刀型貧血——這種疾病長期被醫學界忽視,而如今患者終於迎來治癒的希望 [17]。可以說,以基因編輯為核心的醫學時代已經正式展開。在 CRISPR 已被證實能安全且有效地治癒重症遺傳疾病之後,未來的更多臨床應用——正展開無限可能之門。
露露與娜娜——誕生
從實驗室裡誕生的一個構想到能真正用於患者的臨床療法,這條路從來都不平坦。在CRISPR 的發展過程中,科學家們不僅遭遇了技術上的重重挑戰,更被迫面對一個根本性的問題——科學究竟應該在何處劃下界線?
2018 年,全世界都聽到了這個名字:賀建奎(He Jiankui)。這位中國研究者宣稱,自己已在人類胚胎上進行了基因編輯,並誕下兩名女嬰——露露(Lulu)與娜娜(Nana)。在他上傳到網絡的一段短片中,賀建奎以近乎宣告新時代來臨的語氣說:這對雙胞胎「和其他孩子一樣健康」,彷彿她們象徵著人類基因時代的黎明。
賀建奎宣佈露露與娜娜誕生的首支影片這項實驗的初衷看似單純:關閉 CCR5 基因,讓兩名女嬰能對 HIV 病毒產生抵抗力 [11]。然而問題在於——CCR5 不僅是 HIV 的「入口」,它同時也是免疫系統的重要組件;缺乏它可能會使人更容易感染其他病毒,例如西尼羅河病毒或流感。科學界早已深知這一點。因此,賀建奎的宣告並未引起讚嘆,反而掀起了一場全球譴責的風暴。
幾天之後,在香港的一場國際會議上,賀建奎站在擠滿學者的會場中央。場面並非一場典型的學術討論,而更像是一場關於責任與倫理的審問。正如一位與會者後來回憶的那樣:「那一刻的氛圍,就像一場審判——只是法庭換成了整個科學界。

賀建奎的故事成了一則警示。它讓世人意識到:這項能夠觸及生命密碼的技術,不僅需要知識與勇氣,更需要邊界與自制。
自那之後,人類生殖系統的基因編輯被正式列入全球暫停(moratorium)。
研究焦點全面轉向體細胞(somatic cells)——
這類細胞的改變不會影響遺傳傳承,因此在倫理上相對可被接受。
儘管發生了那場風波,基因療法的腳步從未放慢。隨後幾年間,全球陸續展開數十項臨床試驗,針對罹患嚴重且無法治癒的遺傳疾病的患者。這一次,科學家們選擇循序漸進、嚴守倫理與安全規範——彷彿在每一個實驗的背後,他們仍清晰地看見 露露與娜娜的身影。
基因編輯產業版圖——先驅者
CRISPR 技術的迅速發展,催生了一整個以「基因編輯」為核心的生物科技產業。以下將介紹目前在此領域中最具代表性的上市公司——它們的技術特色、臨床進展與主要挑戰。儘管這些企業各自採取不同的策略與治療切入點,但它們都以精準修改 DNA 為共同核心,致力於將基因編輯轉化為新一代的醫療手段。我們將特別聚焦於CRISPR Therapeutics——作為該領域的開創者與先行者,它奠定了臨床應用的基礎;同時也將探討其他重要參與者:Intellia Therapeutics、Editas Medicine、Beam Therapeutics、Caribou Biosciences,以及近年崛起的Prime Medicine 與 Verve Therapeutics 等新勢力。
CRISPR Therapeutics——首個獲批療法的先驅者
CRISPR Therapeutics 由 Emmanuelle Charpentier 於 2013 年創立,是第一家將基因編輯療法推向市場的公司。該公司與 Vertex Pharmaceuticals 共同為鐮刀型貧血(SCD)與β-地中海型貧血(TDT)患者開發了 exa-cel。療法流程為:採集患者的骨髓造血幹細胞,關閉 BCL11A 基因(此基因會抑制胎兒血紅蛋白的生成),在患者完成前處理後再回輸這些經編輯的細胞。藉此,機體將開始產生健康的血紅蛋白,以取代有缺陷的版本 [3][18]。
在第 3 期臨床試驗中,結果可謂劃時代:93.5% 的 SCD 患者在一年內未再出現血管阻塞危象;而 27 名 TDT 患者中有 25 名 恢復了對輸血的獨立 [19][20]。這一成功促成了 2023 年 的多國監管核准 [15],也成為關鍵里程碑——證明 CRISPR 完全可以成為安全且有效治療的基礎 [21]。
除 exa-cel 外,CRISPR Therapeutics 亦佈局廣泛的研發管線,鞏固其在基因編輯領域的領導者地位。其中,CAR-T 腫瘤療法尤為突出。傳統做法多採用自體(autologous)T 細胞;而 CRISPR Therapeutics 正開發異體(allogeneic)來源的 CAR-T。透過基因編輯,這些供體細胞被去除會引發排斥的受體,並進一步調校以提升抗腫瘤效能 [22][23]。新一代異體 CAR-T(CTX112:CD19;CTX131:CD70)加入了更豐富的編輯組合(如TGFBR2 與 Regnase-1/ZC3H12A),以降低 T 細胞耗竭並增強活性。基於已獲數據,企業啟動了升級版的第 1/2 期試驗,測試下一代加入RenE1、TGFBR2 等額外調控基因剔除的構型,以進一步釋放 T 細胞活性 [26][28]。同時,製程亦更為高效 [29]。目前試驗涵蓋淋巴瘤與白血病(CD19)以及實體腫瘤,如腎癌(CD70)[30][31]。儘管異體 CAR-T 仍面臨排斥與復發等難題 [32][33],公司持續迭代新一代產品,同時亦未放棄自體細胞療法的佈局。
第 2 個策略重點為第 1 型糖尿病。公司與(後續被併購的)ViaCyte 合作,開發以多能幹細胞製備的胰臟前體/胰島細胞進行移植的療法。藉由 CRISPR 編輯,期望讓這些細胞對免疫系統「隱形」,從而不需要免疫抑制藥物 [34][35]。首批臨床試驗已在進行中,目標是恢復患者自體胰島素分泌能力,達成功能性治癒。該計畫雖較血液疾病管線更早期,但其市場潛力極大。
公司的最大優勢在於——作為全行業首家推出 CRISPR 療法(exa-cel/Casgevy)的企業,且與 Vertex 共同開發,CRISPR Therapeutics 因而建立起科學與臨床公信力,並有望在血液病市場獲得顯著市占。僅在美國,SCD 影響約 10 萬人;而雖然 TDT 較少見,但在全球仍是重要患者族群。與 Vertex 的夥伴關係帶來資金、臨床與法規專業與商業化經驗。再加上廣泛管線(自罕病至腫瘤)與關鍵 CRISPR 專利授權(自 Doudna/Charpentier 團隊而得,以合法使用 Cas9 於產品中),皆構成其競爭壁壘。
然而,exa-cel 的商業化挑戰亦相當可觀。此療法需進行造血幹細胞移植,患者在此之前需接受高強度化療前處理 [36][37]。治療費用昂貴(每位患者約 220 萬美元 [38]),且僅能在高度專科中心實施。企業與 Vertex 必須說服醫療體系與保險方:單次介入在經濟上划算——相較於多年累積的 SCD/TDT 併發症治療成本,一次性治療可能更具成本效益 [39]。實務上,早期覆蓋將受限,營收曲線可能低於熱切期待。再者,競爭壓力亦不容小覷:Bluebird Bio 於 2022 年即獲 FDA 核准 Zynteglo 用於 TDT,而 2023 年 12 月——幾乎與 Casgevy 同期——Lyfgenia 亦獲批用於 SCD [2][3]。

這意味著,CRISPR Therapeutics 不僅要面對臨床與監管挑戰,還必須與另一項成熟技術競爭——以病毒載體為基礎的基因療法。接下來的考驗則來自財務層面。儘管與 Vertex 合作密切,這家公司與多數早期生技企業一樣,至今仍處於虧損狀態。整個生技產業的投資者正在施壓,要求企業削減開支、加快獲利。在 2023 年,CRISPR Tx 裁減約 50 名員工(約 10%);至 2025 年 又宣佈新一輪縮編(具體人數未公開),此舉與整個生技行業的成本收縮浪潮一致 [40]。公司解釋稱,這是為了聚焦核心專案與提升營運紀律,這也反映出資本市場對生技企業的期望:更高效率、明確優先順序、精準配置資源 [41]。
換句話說,CRISPR 的科學革命尚未轉化為財務突破。儘管取得了醫學上的成功,但股價並未出現早年投資人所期待的戲劇性飆升。CRSP 股價仍呈波動,但公司依舊穩居產業領先者地位,截至 2025 年中,其市值約 60 億美元,仍超越所有主要競爭對手 [42][43]。
Intellia Therapeutics——體內(in vivo)基因編輯的先驅者
Intellia Therapeutics 於 2014 年在 Jennifer Doudna 的參與下創立,從一開始就以其大膽的戰略選擇而聞名。當多數公司專注於需要採集與回輸患者細胞的 ex vivo 療法時,Intellia 決定走上更具挑戰性的道路——體內(in vivo)基因編輯,即直接在患者體內進行治療。這種方法雖在技術上更為艱難,但能避免複雜的移植程序,並為一次性、長效療法開啟了可能性 [44][45]。
公司建立了一套基於脂質奈米顆粒(LNP)的遞送平台——這與 mRNA 疫苗 所使用的載體技術相同。LNP 將 CRISPR 編輯組件(包括編碼 Cas9 的 mRNA 與導向 RNA)運送至肝臟。選擇該器官並非偶然:肝臟作為天然的「過濾器」,能高效捕捉 LNP,因此成為理想的首個靶點 [44][45]。
旗艦項目 NTLA–2001 專為遺傳性轉甲狀腺素蛋白澱粉沉積症(ATTR)患者設計。該病由突變基因產生的 TTR 蛋白 堆積於神經與心臟所致。治療策略並非修復突變,而是徹底關閉肝細胞內的 TTR 基因,阻止毒性蛋白生成 [46][47]。
臨床試驗中,單次靜脈注射 NTLA–2001 即達到突破性成果:最低劑量可使血漿 TTR 水平下降逾 80%,而較高劑量可降低 90% 以上 [14][48]。更關鍵的是,效果在觀察中維持超過兩年,證實了編輯的長期穩定性 [49]。這一結果遠勝於現有藥物,後者僅能部分抑制或穩定蛋白水平。
在安全性方面,NTLA–2001 表現良好。多數患者僅出現短暫的輸注後反應,嚴重事件極少,且患者仍在追蹤中。綜合數據顯示,其風險可控、效益顯著。基於此,FDA 於 2023 年批准啟動 第 3 期臨床試驗——這是一項隨機、安慰劑對照研究 [50][51][52],旨在驗證該療法於大規模患者群中的安全性與療效。若進展順利,NTLA–2001 可能成為繼 exa-cel 之後全球第二款獲批的 CRISPR 療法,預計時間為 2026–2027 年。
第二個核心項目 NTLA–2002 聚焦於遺傳性血管性水腫(HAE)。該疾病由突變引起的發炎蛋白過度活化導致反覆、甚至致命的組織腫脹。策略與 NTLA–2001 類似:關閉 KLKB1 基因,抑制病理性蛋白生成。早期(第 1/2 期)試驗結果極為正面:單次 CRISPR 治療後,多數患者在數月內未再出現任何腫脹發作 [53][54],部分病患甚至停用了原先的預防用藥而無復發 [54]。最高劑量組中,血中致病蛋白濃度下降約 90%(治療後四個月)[55],且未出現嚴重副作用 [54]。這表明,一次性基因編輯有望達到功能性治癒,取代傳統上需終身用藥或頻繁注射的療程。目前第 2 期試驗持續進行中,全球第 3 期預計於 2025 年內啟動 [56][57]。FDA 已授予其 孤兒藥(Orphan Drug) 與 RMAT 加速資格,歐洲則給予 PRIME 快速通道認定 [58],顯示其獲得高度重視。
此外,Intellia 與 Regeneron 合作,開發以 CRISPR 治療血友病(透過肝臟編輯提升凝血因子)及其他代謝與罕見疾病。公司也考慮涉足腫瘤學,但目前仍主要專注於 in vivo 策略,相對競爭者在 CAR–T 領域的佈局較少。值得注意的是,Intellia 是最早建立系統性 off-target 檢測機制的企業之一。至今尚未發現重大安全問題,臨床數據顯示CRISPR 編輯的非預期切割風險可控制在可接受範圍內。
Intellia Therapeutics 是 in vivo 基因編輯療法領域的真正先驅,其技術有潛力徹底改變遺傳病的治療方式,甚至影響超越基因本身的醫學範式。在 ATTR 與 HAE 臨床研究中,結果顯示:單次輸注 CRISPR 編輯器即可有效「關閉」疾病機制。公司亦成為全球首家獲准啟動 in vivo 第 3 期臨床試驗的企業 [52]。其以脂質奈米顆粒(LNP)為基礎的遞送平台,建立了在CRISPR 運送至體內細胞方面的獨特 know-how。若相關計畫順利完成,Intellia 將不僅擁有更多核准療法,也有望建立穩定的營收來源。
若臨床計畫順利,Intellia 將不僅再添獲批療法,更可建立穩定的收入來源。儘管 ATTR 與 HAE 屬於罕見病,但 HAE 的現行治療成本極高,這為一次性、長效方案的市場接受度提供了助力。此外,Intellia 獲得大型夥伴(如 Regeneron)的支持,並持有 Doudna 團隊(UC Berkeley) 所屬 CRISPR 專利授權,進一步鞏固其技術地位。
ATTR(NTLA–2001)首例人體 in vivo 系統性基因編輯成功案例,實現穩定的 TTR 降幅 >80–90%,並於 2025 年 啟動 第 3 期臨床試驗。
HAE(NTLA–2002)單次輸注後,患者發作次數大幅下降;獲得 RMAT / Orphan Drug(FDA)、PRIME(EMA) 及 Innovation Passport(MHRA) 資格,全球第 3 期臨床預定於 2025 年 啟動。
然而,最大挑戰仍在於——如何將卓越的生物學成果轉化為商業成功。由於這些療法會永久關閉特定基因,監管機構要求進行長期安全性觀察。雖然 CRISPR 可精確切除目標序列,但仍存在off-target(非預期切割)風險——理論上,這類事件若發生在關鍵基因區域,可能於多年後誘發腫瘤轉化等副作用。目前尚未發現此類案例,但患者必須接受多年追蹤,監管機構也可能保持謹慎態度,特別是當 Intellia 進一步將療法擴展至常見病人群時。
另一個風險因素是競爭與技術更新速度。Intellia 仍以傳統 CRISPR–Cas9 系統為核心,而新興公司如 Beam Therapeutics 與 Prime Medicine 則致力於開發更精準的 Base Editing 與 Prime Editing 技術,在特定適應症中可能具更高安全性與效率。在 ATTR 領域,Beam 與 Verve 亦已展開競爭性臨床研究,探索降低 TTR 水平的替代策略。此外,儘管臨床數據具突破性,Intellia 股價於 2022–2023 年間明顯下跌,顯示投資人已意識到——商業化收益仍需時間才能顯現。
截至 2025 年年中,Intellia 的市值約 12 億美元,遠低於 CRISPR Therapeutics,儘管擁有突破性的臨床數據 [42][43]。這顯示市場仍然謹慎評估公司未來的收益潛力。Intellia 很可能需要大量資金以推進全球第 3 期臨床試驗,並支持後續的生產與商業化工作。這可能意味著公司需尋求新合作夥伴或增發股票,對投資人形成一定財務壓力。
從科學角度來看,公司也面臨重大挑戰:如何將 CRISPR 的遞送擴展到肝臟以外的器官。目前使用的脂質奈米顆粒(LNP)能在肝臟內高效累積與釋放編輯組件,這歸功於其與網狀內皮系統(reticuloendothelial system)的交互作用。但若要在肺、腦或肌肉中實現有效基因編輯,仍需開發新型載體或改良化學結構的 LNP。Intellia 已投入早期研究以拓展遞送範圍,然而目前仍處於初步實驗階段。
儘管挑戰重重,Intellia 依然穩居基因療法領域最具前景的企業之一,其多項臨床項目在科學界與患者社群中都引起了高度期待。
Editas Medicine——從眼疾到血液疾病:追趕失去的領先優勢之戰
Editas Medicine 是最早的 CRISPR 公司之一,成立於 2013 年,其創始團隊可謂星光熠熠:包括 Feng Zhang(張鋒)、George Church,以及早期曾參與、後轉至 Intellia 的 Jennifer Doudna。公司獲得了 Broad Institute(張鋒團隊) 的專利授權,並在一段時間內憑藉人類基因組編輯的 Cas9 使用許可,在技術層面擁有顯著優勢。
公司的首個研發目標是Leber 第十型先天性黑朦(LCA10)—— 這是一種由 CEP290 基因突變引起的遺傳性視覺障礙。候選療法 EDIT–101 旨在透過將 CRISPR 載體注射至視網膜下,直接修復基因突變。2019 年,Editas 完成了美國首例人體內(in vivo)CRISPR 給藥。接下來幾年,公司陸續為十多名患者施治,採用不同劑量方案。
然而在 2021–2022 年 公布的結果中,療效僅屬中等水準:部分患者在光敏測試與周邊視野上出現改善,但整體反應並不一致且效果有限,無法確定觀察到的變化是否由療法直接導致 [59]。儘管未出現重大安全問題,但缺乏明確療效證據使 Editas 開始尋求合作夥伴共同推進 EDIT–101 [60],並將內部資源轉向血液疾病領域。
同時,Editas 也在開發一項與 CRISPR Therapeutics 類似的造血幹細胞基因編輯療法,但採用不同的酶系統——Cas12a(Cpf1)。Cas12a 比 Cas9 晚幾年被發現,其切割 DNA 的方式與位置皆不同,可在 BCL11A 基因 的另一區段進行修飾。候選療法 EDIT–301 利用這一機制提升胎兒血紅蛋白(HbF)生成,藉此改善鐮刀型貧血與 β-地中海型貧血症狀。
在 第 1/2 期(RUBY 與 EDITHAL)臨床試驗 中,數據非常亮眼:在 11 名鐮刀型貧血患者中,所有人 HbF 水準顯著上升,且無一人再出現血管阻塞危象 [61][62];在 6 名 β-地中海型貧血患者中,全部成功脫離輸血依賴 [61][62]。觀察期至少 5 個月,部分患者更長。未出現與療法相關的嚴重不良事件,安全性表現與 exa-cel 相當。FDA 為 EDIT–301 授予孤兒藥資格及RMAT 加速通道 [63]。若這些結果能在更大樣本中維持,Editas 將有潛力成為 CRISPR Therapeutics在血液疾病領域的實質競爭者。
EDIT–301 的成功將決定 Editas 的未來走向。公司在近年經歷了大規模重組:更換 CEO、縮減人員與專案,將資源集中於最具潛力的療法上。成本高且風險大的項目(如 EDIT–101)已被暫時擱置。同時,Editas 亦涉足腫瘤學:與 Bristol Myers Squibb (BMS) 合作開發 T 細胞編輯,並獨立研究 NK 細胞編輯 的應用潛力,但這些計畫仍處於早期階段。
Editas 的一大技術優勢是擁有 Cas12a 酶系統,該酶由公司率先引入臨床試驗 [61]。與Cas9 不同,Cas12a 會在 DNA 上留下**「黏性末端」,並識別另一種序列模式(motif),這在某些適應症中更具生物學優勢**。EDIT–301 的臨床結果證明這種替代性核酸酶確實可行,使 Editas 擁有一個更具彈性的技術平台,可根據需要選擇使用 Cas9 或 Cas12a。此外,公司擁有來自 Broad Institute 的強大專利組合。儘管外界如今較少討論其授權收益潛力,但這些法律優勢讓 Editas 能自由運用雙酶系統,並在知識產權層面保持競爭地位。
另一項關鍵優勢是——Editas 挺過了重組的低谷,仍持續推進核心研究。截至 2025 年,公司市值降至約 4–5 億美元,使其成為潛在的收購標的;但若 EDIT–301 獲得成功,投資人也可能迎來可觀回報。對 Editas 而言,比賽仍未結束——只要 EDIT–301 在大型試驗中證明療效與安全,公司仍有機會重返行業第一梯隊。
多年來,Editas 逐漸落後於競爭對手,其早期項目未能吸引足夠市場關注。EDIT–101 的成果不盡理想,引發批評,也顯示公司或許過早上市、缺乏高成功率產品。現任管理層已將全部重心放在 EDIT–301,這雖帶來重建品牌的契機,卻也意味著——只要出現安全或療效問題,公司未來都將面臨嚴重風險。
與 CRISPR Therapeutics 相比,Editas 缺乏強而有力的戰略夥伴來支持研發與商業化(與 BMS 的合作僅限於早期腫瘤項目)。在競爭激烈的環境下,Editas 必須證明自己能提供獨特價值。雖然 Cas12a 是科學層面的亮點,但從醫師與患者的角度,臨床數據與可及性才是最關鍵的。
財務上,Editas 可能仍需新合作夥伴或額外融資以推進昂貴的第 3 期臨床試驗。此外,公司尚未建立起如 CRISPR Tx 般強勢的市場形象,因此在投資者之間的信任度較低。然而,只要 EDIT–301 能產出強勁結果,Editas 仍有真實機會重返 CRISPR 領域的主舞台。
結語(第一部)
Editas、Intellia 與 CRISPR Therapeutics 開啟了基因編輯商業化的時代,證明 CRISPR–Cas9 不僅是科學革命的里程碑,更可成為新商業模式的基石。它們的迅速成長與上市行動吸引了整個產業的目光,並為該領域注入了數以億計美元的資金與信心。
然而,這僅僅是故事的開端。在第二部中,我們將深入探討新一波加入競賽的公司,同時回顧 2023–2025 年間 最新的臨床成果,以及那些可能決定——基因編輯能否成為現代醫學長久支柱的挑戰。
🧬
本文僅供教育與資訊參考之用。不構成任何投資建議或依據法律定義之要約。作者對根據本文內容所作出的任何投資決策不承擔責任。
參考文獻(部分主要來源)
· U.S. Food and Drug Administration(美國食品藥物管理局) – 關於首個 CRISPR 療法(Casgevy)用於鐮刀型貧血的新聞稿 [2][3]。
· Innovative Genomics Institute, “CRISPR Clinical Trials: A 2024 Update” – 關於 CRISPR 臨床試驗現況的綜述(涵蓋 SCD/TDT、ATTR、HAE、CAR-T 的臨床數據)[111][48][53][70]。
· STAT News, Jason Mast, “The CRISPR companies are not OK” (2025) – 產業挑戰與學術突破與財務現實之間落差的分析 [1][40]。
· Nanalyze, “When Will Gene Editing Stocks Finally Take Off?” (2025) – 基因編輯公司股價與估值分析 [109][43]。
· Nature News, Heidi Ledford, “World first: ultra-powerful CRISPR treatment trialled in a person” (2025) – 首次在人類中應用 prime editing 的報導 [10][9]。
· The Guardian, Ian Sample, “Chinese scientist who edited babies’ genes jailed for three years” (2019) – 關於賀建奎事件及其倫理後果 [12][11]。
· Fierce Biotech, James Waldron, “Graphite’s hopes for sickle cell ‘cure’ blunted after first patient dosed experiences serious event” (2023) – Graphite Bio 試驗因不良反應終止的報導 [103]。
· U.S. FDA – 關於 Casgevy 與同期核准的慢病毒基因療法(Lyfgenia)的適應症與作用機制說明 [2][3]。(以上來源皆為高可信度英語出版物,內容涵蓋截至 2025 年 8 月的最新科研與財務資料。)