Rewolucja w edycji genów – technologia, firmy i perspektywy (2025), cz. I
CRISPR: odkrycie na miarę antybiotyku i DNA. Czy jesteśmy o krok od terapii na raka i HIV?
Niniejszy materiał ma charakter informacyjno-analityczny i nie stanowi porady inwestycyjnej.
🐣🐣
Jiankui
Wprowadzenie
Edycja genów to jedna z najbardziej przełomowych technologii biomedycznych współczesności. Umożliwia precyzyjne modyfikowanie DNA, co otwiera drogę do leczenia chorób genetycznych u źródła, modyfikowania komórek odpornościowych w onkologii i potencjalnego ograniczania predyspozycji do chorób cywilizacyjnych. Szczególne znaczenie zyskał system CRISPR–Cas9, za który w 2020 r. przyznano Nagrodę Nobla w chemii. Komitet wskazywał, że technologia „może urzeczywistnić marzenie o wyleczeniu chorób dziedzicznych” [1]. Od tamtej pory zainwestowano miliardy dolarów, a na całym świecie powstały dziesiątki firm, które próbują przełożyć tę obietnicę na praktykę kliniczną.
W drugiej połowie 2025 r. rewolucja CRISPR wchodzi w dojrzalszą fazę: pierwsze terapie zostały już zatwierdzone i trafiają do pacjentów [2][3], a kolejne znajdują się w zaawansowanych badaniach klinicznych (anemia sierpowata – SCD, beta-talasemia – TDT, ATTR, HAE, onkologia). W tym materiale porządkujemy podstawy, kamienie milowe, kluczowe spółki oraz realia komercjalizacji – z naciskiem na CRISPR Therapeutics, Intellia i Editas.”
Czym jest edycja genów i technologia CRISPR-Cas9?
Edycja genów polega na precyzyjnym manipulowaniu materiałem genetycznym DNA poprzez dodawanie, usuwanie lub zmienianie fragmentów genów.
Próby inżynierii genetycznej prowadzone są od kilkudziesięciu lat, jednak wcześniejsze metody okazywały się kosztowne i skomplikowane. Prawdziwy przełom nastąpił w 2012 r., gdy Jennifer Doudna i Emmanuelle Charpentier opracowały technologię CRISPR–Cas9.
Mechanizm CRISPR–Cas9 został zaczerpnięty z naturalnego systemu obronnego bakterii przeciw wirusom. Udało się go przeprogramować tak, by przecinał DNA w ściśle określonym miejscu. W praktyce działa on jak molekularne ‘nożyczki z GPS’ – enzym Cas9 tnie DNA dokładnie tam, gdzie zaprowadzi go krótki RNA-przewodnik komplementarny do docelowej sekwencji genu [4][5]. Po przecięciu obu nici DNA do pracy włączają się naturalne mechanizmy naprawcze komórki, które łączą przerwane końce. To właśnie wtedy można wprowadzić zmiany, dezaktywować wadliwy gen albo wstawić poprawny fragment DNA.
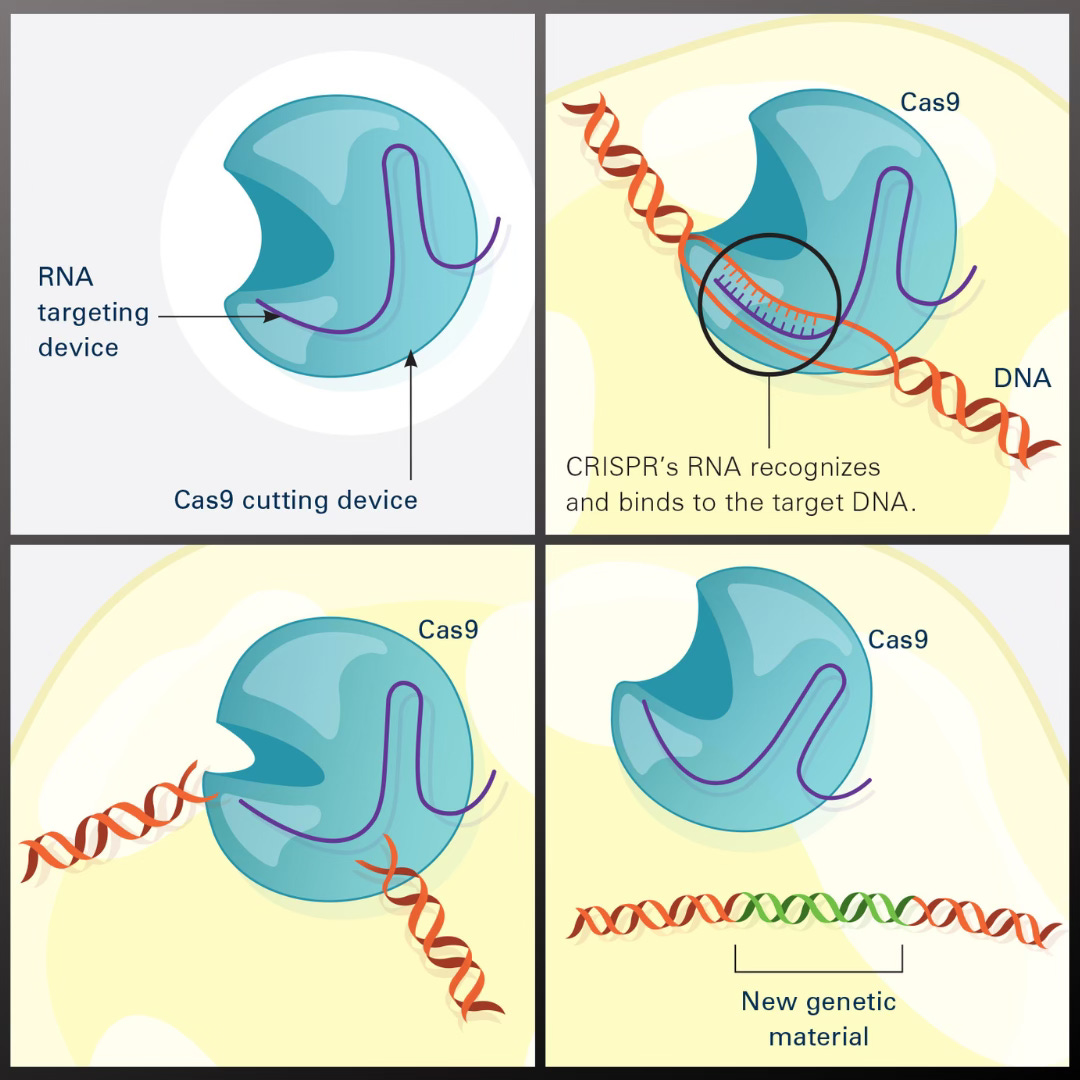
Dlaczego CRISPR wzbudził tak silne emocje? W porównaniu z wcześniejszymi metodami edycji genów – takimi jak nukleazy cynkowe (ZFN) czy TALEN – system CRISPR–Cas9 okazał się prostszy, tańszy i bardziej uniwersalny. Zaprojektowanie RNA prowadzącego do wybranego genu można wykonać komputerowo, dzięki czemu laboratoria na całym świecie mogły błyskawicznie zaadaptować tę technologię.
CRISPR umożliwia edycję praktycznie dowolnego genu w niemal każdym organizmie: od ludzkich komórek, przez zwierzęta laboratoryjne, po rośliny uprawne. Zastosowania medyczne są szczególnie obiecujące – można naprawiać mutacje powodujące choroby genetyczne (takie jak anemia sierpowata czy mukowiscydoza), wyłączać geny potrzebne wirusom do przetrwania w organizmie (np. HIV) czy przeprogramowywać komórki odpornościowe do walki z nowotworami.
Perspektywa leczenia nieuleczalnych chorób u ich genetycznych podstaw, sprawiła, że CRISPR określa się mianem technologii rewolucyjnej. Często porównuje się go do odkrycia struktury DNA czy wynalezienia antybiotyków.
CRISPR–Cas9 to nie jedyna technika edycji genów, lecz raczej pierwsza generacja nowych metod. Obecnie rozwijane są jej udoskonalenia określane mianem CRISPR 2.0: edytowanie baz (base editing) oraz edytowanie pierwotne (prime editing). Edytory bazowe, opracowane przez Davida Liua z Harvardu, umożliwiają punktowe zmiany pojedynczych „liter” DNA bez przecinania podwójnej helisy, co zwiększa bezpieczeństwo i pozwala korygować mutacje punktowe [8]. Prime editing, opisany w 2019 r., łączy mechanizm CRISPR z odwrotną transkryptazą i umożliwia wstawianie lub zamianę całych fragmentów DNA w sposób precyzyjny [9]. Uznaje się go za najbardziej uniwersalne narzędzie, ponieważ teoretycznie pozwala na wprowadzenie dowolnej zmiany w genomie. Prime editing zastosowano po raz pierwszy eksperymentalnie na człowieku w 2025 r. [10].
W maju 2025 r. firma Prime Medicine ogłosiła pierwsze wyniki kliniczne u pacjenta z przewlekłą chorobą ziarniniakową (CGD). Czasopismo Nature opisało to wydarzenie jako pierwsze w historii zastosowanie prime editingu u człowieka [117].
Historia rozwoju technologii
Choć prawdziwy boom na CRISPR przypadł na początek drugiej dekady XXI wieku, sama idea ingerowania w geny ma znacznie dłuższą historię. Już w latach 90. rozwijano nukleazy cynkowe, a nawet sztucznie zaprojektowano pierwsze „nożyczki molekularne”. Około 2011 r. pojawiły się nukleazy TALEN, oparte na bakteryjnych białkach wiążących DNA. Obie metody działały, ale ich projektowanie było skomplikowane i kosztowne, co ograniczało tempo zastosowań medycznych.
Przełom nastąpił w 2012 r, gdy Emmanuelle Charpentier i Jennifer Doudna opublikowały pracę pokazującą, że bakteryjny system CRISPR–Cas9 można wykorzystać jako narzędzie do precyzyjnego cięcia dowolnego DNA [1]. Niezależnie nad podobnym rozwiązaniem pracował zespół Fenga Zhanga z Broad Institute, którego publikacja ukazała się kilka miesięcy później. Rozpoczęło to zarówno wyścig naukowy, jak i spór patentowy między Uniwersytetem Kalifornijskim a Broad Institute o prawa do technologii wartej setki milionów dolarów. Ostatecznie obie strony uzyskały część patentów, a firmy biotechnologiczne licencjonują dziś CRISPR od jednego z tych podmiotów. Spór ten dobrze pokazuje, jak cennym i pożądanym odkryciem okazała się ta technologia.
Na fali entuzjazmu w latach 2013–2015 zaczęły powstawać pierwsze startupy biotechnologiczne skupione na edycji genów. W 2013 r. założono Editas Medicine, którego współinicjatorami byli m.in. Feng Zhang i pionier genomiki George Church. Rok później, z udziałem Jennifer Doudny, powstała Intellia Therapeutics, a w Szwajcarii Emmanuelle Charpentier współzałożyła CRISPR Therapeutics. Te trzy spółki stworzyły pierwszą falę firm rozwijających technologię CRISPR i w kolejnych latach zadebiutowały na giełdzie NASDAQ, pozyskując setki milionów dolarów od inwestorów. Towarzyszył temu ogromny rozgłos medialny: CRISPR pojawiał się na łamach „New York Timesa”, w popularnych czasopismach i programach naukowych. W tamtym okresie mówiono wręcz o „CRISPR-manii”, podczas której oczekiwano szybkiego pojawienia się cudownych leków i przełomu w leczeniu raka, HIV, chorób genetycznych oraz wielu innych schorzeń.
Pierwsze próby kliniczne z użyciem CRISPR u ludzi rozpoczęły się w połowie drugiej dekady XXI wieku. Już w 2016 r. chiński zespół onkologów podał pacjentowi z rakiem płuca limfocyty T edytowane metodą CRISPR. Była to pionierska, eksperymentalna próba, której wyniki nie zostały jednak szeroko opisane [13].
Kolejny krok nastąpił w 2019 r. w Stanach Zjednoczonych, gdzie rozpoczęto badanie kliniczne w anemii sierpowatej. Komórki macierzyste szpiku pacjentki Victorii Gray zmodyfikowano tak, aby produkowały zdrową hemoglobinę. Wkrótce potem podobne podejście zastosowano w leczeniu beta-talasemii, innej ciężkiej choroby krwi. W tym samym roku firma Editas rozpoczęła pionierską próbę terapii dziedzicznej ślepoty Lebera. Pacjentom wstrzyknięto do oka wektor z CRISPR, co było pierwszym w USA podaniem edytora genów bezpośrednio do organizmu (in vivo).
W 2020 r. Intellia Therapeutics poszła o krok dalej, dokonując pierwszej w świecie systemowej edycji genu wewnątrz ciała pacjenta. W terapii NTLA–2001 pacjentowi podano dożylnie nanocząstki lipidowe z mRNA kodującym CRISPR, które trafiły do wątroby i wyłączyły gen odpowiedzialny za amyloidozę transtyretynową – śmiertelną chorobę wywołaną odkładaniem patologicznego białka. W 2021 r. ogłoszono, że ta jednorazowa terapia obniżyła poziom toksycznego białka TTR o ponad 80% [14]. Wynik ten uznano za przełom, ponieważ po raz pierwszy potwierdzono skuteczność systemowej edycji genów in vivo u człowieka.
W listopadzie 2023 r. brytyjska MHRA jako pierwsza na świecie zatwierdziła terapię Casgevy (CRISPR Therapeutics) dla SCD i TDT. W USA FDA dopuściła Casgevy najpierw dla SCD (8 grudnia 2023 r.), a następnie dla TDT (16 stycznia 2024 r.). W Unii Europejskiej terapia uzyskała warunkowe dopuszczenie 13 lutego 2024 r. (dla chorych od 12. roku życia). Niedługo później na rynku pojawiła się konkurencyjna genoterapia Lyfgenia (Bluebird Bio) [2][3][116].
Jedenaście lat zajęło przejście od pierwszych publikacji o CRISPR do rejestrowania terapii ratujących życie. „Przejście z laboratorium do zatwierdzonej terapii w jedynie 11 lat to naprawdę niezwykłe osiągnięcie” – skomentowała Jennifer Doudna na wieść o aprobacie Casgevy [16]. Podkreśliła też symboliczny fakt, że pierwsza terapia CRISPR dotyczy właśnie anemii sierpowatej. Choroby, którą medycyna przez dekady zaniedbywała, dając teraz szansę na wyleczenie tysięcy cierpiących osób [17]. Można powiedzieć, że era medycyny opartej na edycji genów właśnie się rozpoczyna. Po udowodnieniu, że CRISPR może bezpiecznie i skutecznie uleczyć ciężkie choroby, droga dla kolejnych zastosowań staje otworem.
Lulu and Nana — The Birth
Droga od pomysłu rodzącego się w laboratorium do terapii stosowanej u pacjentów nigdy nie jest prosta. W przypadku CRISPR na tej drodze pojawiło się nie tylko wiele technicznych przeszkód, ale także pytania o granice, których nauka nie powinna przekraczać.
W 2018 roku cały świat usłyszał nazwisko He Jiankui. Chiński badacz ogłosił, że przeprowadził edycję genów w ludzkich embrionach i że na świat przyszły dwie dziewczynki – Lulu i Nana. W krótkim nagraniu wideo, które zamieścił w sieci, mówił o nich niemal jak o symbolu nowej ery, podkreślając, że są „tak zdrowe jak każde inne dzieci”.
Pierwsze nagranie He Jiankui, w którym ogłosił narodziny Lulu i NanaCel eksperymentu był prosty w założeniu: wyłączyć gen CCR5, by dziewczynki były odporne na zakażenie wirusem HIV [11]. Problem w tym, że CCR5 to nie tylko furtka dla HIV, lecz także element układu odpornościowego, którego brak może zwiększać podatność na inne infekcje, jak wirus Zachodniego Nilu czy grypa. Naukowcy wiedzieli o tym doskonale. Dlatego zamiast zachwytu, ogłoszenie wywołało falę potępienia.
Kilka dni później, na konferencji w Hongkongu, Jiankui stanął przed pełną salą badaczy. Zamiast naukowej dyskusji toczyła się rozmowa o odpowiedzialności i etyce. Jeden z obecnych wspominał później, że atmosfera przypominała proces – tyle że to nie sąd, a społeczność naukowa wydawała werdykt.

Historia Jiankui stała się ostrzeżeniem. Uświadomiła, że technologia, która pozwala dotknąć samego kodu życia, wymaga nie tylko wiedzy i odwagi, ale przede wszystkim granic.
Od tamtej pory edycja ludzkiej linii zarodkowej została objęta moratorium. Badania przeniesiono wyłącznie na komórki somatyczne, które można zmieniać bez wpływu na dziedziczenie.
Mimo tego incydentu rozwój terapii nie zwolnił. Kolejne lata przyniosły dziesiątki programów klinicznych dla pacjentów cierpiących na ciężkie, nieuleczalne choroby genetyczne. Tym razem badacze starali się iść krok po kroku, zachowując rygor bezpieczeństwa i etyki, jakby wciąż mieli przed oczami historię Lulu i Nany.
Krajobraz branży edycji genów – pionierzy
Dynamiczny rozwój technologii CRISPR pociągnął za sobą powstanie całego sektora biotechnologicznego skupionego na edycji genomu. Poniżej przedstawiamy najważniejsze publiczne firmy zajmujące się tą dziedziną, ich profile, dokonania oraz wyzwania. Każda z nich obrała nieco inną strategię i niszę terapeutyczną, choć wszystkie łączy wykorzystanie precyzyjnej modyfikacji DNA jako metody leczenia. Szczególnie przyjrzymy się spółce CRISPR Therapeutics – z racji jej pionierskiej pozycji – ale omówimy też innych kluczowych graczy: Intellia, Editas, Beam, Caribou, a także nowsze firmy jak Prime Medicine czy Verve Therapeutics.
CRISPR Therapeutics – pionier z pierwszą zatwierdzoną terapią
CRISPR Therapeutics, założona w 2013 r. przez Emmanuelle Charpentier, to pierwsza firma, która wprowadziła na rynek terapię opartą na edycji genów. Wspólnie z Vertex Pharmaceuticals opracowała exa-cel dla pacjentów z anemią sierpowatą i beta-talasemią. Terapia polega na pobraniu komórek macierzystych szpiku, wyłączeniu genu BCL11A, który hamuje produkcję hemoglobiny płodowej, i przeszczepieniu ich z powrotem po przygotowaniu chorego. Dzięki temu organizm zaczyna wytwarzać zdrową hemoglobinę zamiast wadliwej [3][18].
W badaniach fazy 3 wyniki były przełomowe: 93,5% pacjentów z anemią sierpowatą nie doświadczyło kryzysów naczyniowych w ciągu roku, a 25 z 27 chorych na beta-talasemię odzyskało niezależność od transfuzji krwi [19][20]. Sukces ten doprowadził do zatwierdzeń regulatorów w 2023 r. [15] i stanowi kamień milowy potwierdzający, że CRISPR może być podstawą bezpiecznych i skutecznych terapii [21].
Poza terapią exa-cel CRISPR Therapeutics rozwija szerokie portfolio projektów, co umacnia jej pozycję lidera w dziedzinie edycji genów. Szczególne miejsce zajmują nowatorskie terapie onkologiczne CAR–T. W tradycyjnym podejściu wykorzystuje się autologiczne limfocyty T pacjenta, natomiast CRISPR Therapeutics pracuje nad allogenicznymi CAR–T z komórek dawcy. Dzięki edycji genów pozbawia się je receptorów odpowiedzialnych za odrzucenie oraz modyfikuje tak, by skuteczniej zwalczały nowotwory [22][23]. Nowa generacja allogenicznych CAR–T (CTX112 – CD19; CTX131 – CD70) wykorzystuje rozszerzony zestaw edycji (m.in. TGFBR2 i Regnase–1/ZC3H12A), by ograniczać wyczerpanie limfocytów T i zwiększać aktywność. Na podstawie uzyskanych wyników rozpoczęto ulepszone badania fazy 1/2 z następną generacją CAR–T, wzbogaconych o dodatkowe modyfikacje, takie jak usunięcie genów RenE1 i TGFBR2, które normalnie ograniczają aktywność limfocytów T [26][28]. Nowe wersje mają także bardziej efektywny proces produkcji [29]. Obecnie testowane są w chłoniakach i białaczkach (CD19) oraz w guzach litych, m.in. raku nerki (CD70) [30][31]. Choć allogeniczne CAR–T nadal borykają się z problemem odrzutu i nawrotów [32][33], firma intensywnie rozwija kolejne generacje, jednocześnie nie rezygnując z autologicznych terapii komórkowych.
Drugim strategicznym obszarem CRISPR Therapeutics jest cukrzyca typu 1. We współpracy (później przejętej) z ViaCyte rozwijana jest terapia oparta na przeszczepianiu pacjentom komórek trzustki wytworzonych z pluripotencjalnych komórek macierzystych. Edycja CRISPR ma sprawić, że komórki te będą „niewidzialne” dla układu odpornościowego i nie będą wymagały leków immunosupresyjnych [34][35]. Pierwsze próby kliniczne są w toku. Celem jest przywrócenie zdolności organizmu do samodzielnej produkcji insuliny, a w konsekwencji funkcjonalne wyleczenie cukrzycy. Projekt znajduje się na wcześniejszym etapie niż terapie krwi, lecz jego potencjał rynkowy jest ogromny.
Największym atutem firmy jest fakt, że jako pierwsza w branży wprowadziła na rynek terapię CRISPR (exa-cel/Casgevy), rozwijaną wspólnie z Vertex. Dzięki temu zyskała wiarygodność naukową i kliniczną oraz potencjalnie znaczący udział w rynku terapii chorób krwi. W samych Stanach Zjednoczonych anemia sierpowata dotyka ok. 100 tys. osób, a choć beta-talasemia jest rzadsza, globalnie stanowi istotną populację pacjentów. Partnerstwo z Vertex zapewnia CRISPR Therapeutics finansowanie, know-how kliniczne i doświadczenie regulacyjne w komercjalizacji produktu. Dodatkową przewagą jest szeroki pipeline – od chorób rzadkich po onkologię – oraz dostęp do kluczowych patentów CRISPR (licencje od zespołu Doudna/Charpentier umożliwiają korzystanie z Cas9 w produktach firmy).
Exa-cel to przełom, ale komercjalizacja takiej terapii jest dużym wyzwaniem. Procedura wymaga przeszczepu szpiku, a więc wcześniejszej intensywnej chemioterapii [36][37]. Terapia jest kosztowna (ok. 2,2 mln USD za pacjenta [38]) i dostępna jedynie w wyspecjalizowanych ośrodkach. Firma wraz z Vertex musi przekonać systemy zdrowotne i ubezpieczycieli, że jednorazowa interwencja jest ekonomicznie uzasadniona, wskazując na porównywalne lub wyższe koszty wieloletniego leczenia powikłań SCD i TDT [39]. W praktyce początkowa dostępność będzie ograniczona, a przychody mogą być umiarkowane względem oczekiwań. Dodatkowym wyzwaniem jest konkurencja: Bluebird Bio uzyskał w 2022 r. aprobatę FDA dla terapii Zynteglo w beta-talasemii, a w grudniu 2023 r. – niemal równolegle z Casgevy – FDA zatwierdziła także terapię Lyfgenia w anemii sierpowatej [2][3].

Oznacza to, że CRISPR Therapeutics musi konkurować z inną zaawansowaną technologią, czyli terapiami genowymi opartymi na wektorach wirusowych. Kolejnym wyzwaniem pozostaje sytuacja finansowa. Mimo partnerstwa z Vertex spółka, podobnie jak większość biotechnologii we wczesnej fazie, dotąd generowała straty. W całej branży narasta presja inwestorów na ograniczanie kosztów i szybsze osiąganie zysków. W 2023 r. CRISPR Tx zredukował etaty o ok. 50 osób (~10%), a w 2025 r. ogłoszono kolejne cięcia (liczby nieujawniono), co wpisuje się w szerszą falę oszczędności w biotechu [40]. Decyzję uzasadniono koniecznością koncentracji na kluczowych projektach i większą dyscypliną operacyjną, co sygnalizuje, że rynek kapitałowy oczekuje od firm biotechnologicznych wyższej efektywności i bardziej selektywnego podejścia do pipeline’u [41].
Innymi słowy, rewolucja naukowa CRISPR nie przełożyła się jeszcze na przełom finansowy. Mimo sukcesu medycznego, kurs akcji spółki nie wzrósł tak spektakularnie, jak kiedyś oczekiwano. Notowania CRSP pozostają zmienne, ale firma wciąż utrzymuje pozycję lidera, z kapitalizacją rynkową ok. 6 mld USD w połowie 2025 r., przewyższając wszystkich konkurentów [42][43].
Intellia Therapeutics – pionier edycji genów in vivo
Intellia Therapeutics, założona w 2014 r. przy udziale Jennifer Doudny, od początku wyróżniała się odważnym wyborem strategii. Podczas gdy większość firm koncentrowała się na terapiach ex vivo, wymagających pobierania i przeszczepiania zmodyfikowanych komórek pacjenta, Intellia postawiła na edycję in vivo – bezpośrednio w organizmie chorego. To podejście, technicznie bardziej wymagające, eliminuje konieczność złożonych procedur transplantacyjnych i otwiera drogę do potencjalnie jednorazowych terapii o szerokim zastosowaniu[44][45].
Firma zbudowała platformę opartą na nanocząstkach lipidowych (LNP) – nośnikach znanych ze szczepionek mRNA. LNP przenoszą do wątroby zestaw edycyjny CRISPR: mRNA kodujące enzym Cas9 oraz przewodnik RNA. Wybór organu nie jest przypadkowy – wątroba działa jak naturalny „filtr” dla LNP, co czyni ją idealnym celem pierwszych terapii [44][45].
Flagowym programem jest NTLA–2001, rozwijany dla pacjentów z dziedziczną amyloidozą transtyretynową (ATTR), chorobą powodowaną przez odkładanie się wadliwego białka TTR w nerwach i sercu. Celem terapii nie jest naprawa samej mutacji, lecz całkowite wyłączenie genu TTR w hepatocytach, aby zatrzymać produkcję toksycznego białka [46][47].
W badaniach klinicznych pojedyncze dożylne podanie NTLA–2001 przyniosło przełomowe rezultaty. Najniższa dawka obniżyła stężenie TTR w osoczu o ponad 80%, a wyższe dawki o ponad 90% [14][48]. Co kluczowe, efekt utrzymywał się co najmniej dwa lata w obserwacji, potwierdzając trwałość edycji genomu [49]. To wyniki wyraźnie przewyższające skuteczność dostępnych leków, które stabilizują TTR lub redukują jego ilość tylko w ograniczonym zakresie.
Pod względem bezpieczeństwa NTLA–2001 prezentuje korzystny profil. Najczęściej obserwowano krótkotrwałe objawy poinfuzyjne, a poważniejsze zdarzenia odnotowano u nielicznych pacjentów, którzy nadal pozostają w badaniu. Dane sugerują, że działania niepożądane są możliwe do opanowania w stosunku do korzyści terapeutycznych.
Na tej podstawie FDA w 2023 r. zezwoliła na rozpoczęcie fazy 3 NTLA–2001 – randomizowanego badania [50][51] kontrolowanego placebo, które ma potwierdzić skuteczność i bezpieczeństwo w dużej populacji [52]. Jeśli zakończy się powodzeniem, NTLA–2001 może stać się drugą terapią CRISPR dopuszczoną do obrotu, po exa-cel, prawdopodobnie w latach 2026–2027 r.
Drugim kluczowym programem Intellii jest NTLA–2002, rozwijany w terapii dziedzicznego obrzęku naczynioruchowego – rzadkiej choroby, w której mutacja prowadzi do nadmiernej aktywności białka prozapalnego i powoduje nawracające, zagrażające życiu obrzęki różnych części ciała. Strategia jest analogiczna do NTLA–2001: chodzi o wyłączenie genu KLKB1, który koduje problematyczne białko. Wczesne wyniki z fazy 1/2 są bardzo obiecujące. Po jednorazowym podaniu CRISPR większość pacjentów nie doświadczyła żadnych ataków obrzęku przez wiele miesięcy obserwacji [53][54]. U części chorych możliwe było nawet odstawienie dotychczasowych leków profilaktycznych, bez nawrotu napadów [54]. Cztery miesiące po zabiegu stężenie szkodliwego białka spadło o około 90% w najwyższej dawce [55]. Co ważne, nie zgłoszono poważnych działań niepożądanych; terapia była dobrze tolerowana [54]. Dane te sugerują, że jednorazowa edycja genu może zapewnić funkcjonalne wyleczenie HAE – choroby, która w standardowym leczeniu wymaga stałego stosowania leków lub częstych iniekcji. Obecnie trwa faza 2, a globalną fazę 3 Intellia planuje rozpocząć jeszcze w 2025 r. [56][57]. FDA przyznała terapii status leku sierocego oraz przyspieszonej ścieżki RMAT, a w Europie otrzymała status PRIME, co podkreśla uznanie jej potencjału [58].
Intellia rozwija także inne projekty. W partnerstwie z Regeneron bada zastosowania CRISPR m.in. w hemofilii (edycja wątroby w celu zwiększenia poziomu brakującego czynnika krzepnięcia) oraz w innych chorobach metabolicznych i rzadkich. Firma rozważa także wejście w onkologię, choć dotąd mniej aktywnie niż konkurenci działała w obszarze CAR–T, skupiając się głównie na strategiach in vivo. Na uwagę zasługuje fakt, że Intellia jako jedna z pierwszych opracowała systematyczne metody śledzenia efektów ubocznych edycji (off-targets). Do tej pory nie wykryto poważnych problemów, a uzyskane wyniki kliniczne sugerują, że ryzyko niepożądanych cięć CRISPR można utrzymać na akceptowalnym poziomie.
Intellia jest pionierem w segmencie terapii in vivo, co może całkowicie zmienić sposób leczenia chorób genetycznych i wykraczać poza samą genetykę. Wyniki kliniczne w ATTR i HAE pokazują, że jednorazowa infuzja edytora może skutecznie wyłączyć chorobę. Firma jako pierwsza uzyskała zgodę na rozpoczęcie fazy 3 w terapii in vivo [52], a jej platforma oparta na nanocząstkach lipidowych daje unikalny know-how w dostarczaniu CRISPR do komórek. Jeśli programy zakończą się sukcesem, Intellia zdobędzie nie tylko kolejne zatwierdzone terapie, lecz także stabilne źródło przychodów. Co prawda ATTR i HAE należą do chorób rzadkich, ale w przypadku HAE obecne leczenie jest kosztowne, co sprzyja przyjęciu rozwiązania potencjalnie trwałego. Dodatkowym atutem jest wsparcie dużych partnerów, takich jak Regeneron, oraz dostęp do licencji na CRISPR z konsorcjum Doudny (UC Berkeley).
ATTR (NTLA–2001). Pierwsza udana systemowa edycja genu in vivo u człowieka, stabilne redukcje TTR (>80–90%) i wejście do fazy 3 w 2025 r.
HAE (NTLA–2002). Jednorazowa infuzja znacząco ograniczyła napady; terapia ma statusy RMAT/Orphan (FDA), PRIME (EMA) i Innovation Passport (MHRA); globalna faza 3 zapowiedziana na 2025 r.
Największym wyzwaniem pozostaje przełożenie doskonałych wyników biologicznych na sukces komercyjny. Terapie in vivo będą musiały przejść długotrwałe oceny bezpieczeństwa, ponieważ skutki trwałego wyłączenia genów nie są w pełni znane. Choć edytor usuwa konkretny cel, ryzyko off-targetów (przypadkowych cięć w innych miejscach genomu) istnieje i teoretycznie może po latach prowadzić np. do transformacji nowotworowej. Dotychczas takich przypadków nie zaobserwowano, ale pacjenci muszą być monitorowani latami. Regulatorzy mogą podchodzić ostrożnie, zwłaszcza jeśli w przyszłości Intellia zechce kierować swoje terapie do szerokich populacji (np. w chorobach powszechnych).
Kolejnym czynnikiem ryzyka jest konkurencja i szybko zmieniająca się technologia. Intellia bazuje na klasycznym CRISPR–Cas9, podczas gdy nowe firmy – takie jak Beam Therapeutics czy Prime Medicine – rozwijają bardziej precyzyjne edytory (base editing, prime editing), które mogą okazać się korzystniejsze w niektórych wskazaniach. W ATTR pojawiają się też konkurencyjne terapie genowe: Beam czy Verve testują alternatywne podejścia do obniżania poziomu TTR. Dodatkowo, mimo przełomowych danych klinicznych, kurs akcji Intellii w latach 2022–2023 r. istotnie spadł, bo inwestorzy zaczęli rozumieć, że zyski z komercjalizacji nie pojawią się szybko.
W połowie 2025 r. kapitalizacja Intellii wynosiła ok. 1,2 mld USD, czyli znacznie mniej niż w przypadku CRISPR Therapeutics, mimo przełomowych danych klinicznych [42][43]. To pokazuje, że rynek wciąż ostrożnie wycenia przyszłe przychody spółki. Intellia prawdopodobnie będzie potrzebować znacznych środków na globalne badania fazy 3, a także późniejszą produkcję i komercjalizację. Może to oznaczać konieczność kolejnych partnerstw lub emisji akcji, rodząc presję na inwestorów.
Z naukowego punktu widzenia firma stoi przed wyzwaniem dostarczenia CRISPR poza wątrobę. Nanocząstki lipidowe sprawdzają się doskonale w tym organie, który naturalnie akumuluje je dzięki działaniu układu siateczkowo-śródbłonkowego, ale aby skutecznie edytować geny w płucach, mózgu czy mięśniach, potrzebne będą nowe rozwiązania – inne wektory lub modyfikowana chemia LNP. Intellia inwestuje w badania nad poszerzeniem zasięgu dostarczania, choć to wciąż etap wczesnych prac.
Mimo tych wyzwań spółka pozostaje w ścisłej czołówce najbardziej obiecujących firm terapii genowych, a jej projekty budzą duże oczekiwania zarówno w środowisku naukowym, jak i wśród pacjentów.
Editas Medicine – od chorób oczu do krwi: walka o nadrobienie dystansu
Editas Medicine była jedną z pierwszych firm CRISPR, powstałą w 2013 r. z imponującą listą założycieli: Feng Zhang, George Church, a początkowo także Jennifer Doudna, która później przeniosła się do Intellii. Spółka uzyskała dostęp do patentów Broad Institute (Zhang) i przez pewien czas miała przewagę w postaci licencji na enzym Cas9 w kontekście edycji ludzkiego genomu.
Pierwszym celem Editas była wrodzona ślepota Lebera typu 10 (LCA10). To choroba genetyczna oczu wywołująca mutację w genie CEP290. Kandydat EDIT–101 miał umożliwiać bezpośrednią edycję genu w siatkówce pacjenta poprzez podanie wektora CRISPR pod siatkówkę. W 2019 r. Editas przeprowadziła pierwsze w USA podanie CRISPR do organizmu człowieka. W kolejnych latach leczono kilkunastu pacjentów różnymi dawkami. Wyniki ogłoszone w latach 2021–2022 r. były jednak umiarkowane: u części pacjentów zanotowano poprawę widzenia w testach światła i obszarów peryferyjnych, ale efekty nie były jednoznaczne ani spektakularne, a pewność, że wynik to efekt terapii, pozostała ograniczona [59]. Nie zgłoszono poważnych problemów bezpieczeństwa, ale brak wyraźnego dowodu skuteczności sprawił, że Editas zaczęła szukać partnera do dalszego rozwoju EDIT–101 [60], koncentrując własne zasoby na chorobach krwi.
Równolegle Editas rozwijała program edycji komórek krwiotwórczych, podobny do strategii CRISPR Therapeutics, lecz oparty na innym enzymie – Cas12a (Cpf1). Cas12a, odkryta kilka lat po Cas9, tnie DNA w odmienny sposób i w innym miejscu genu BCL11A. Terapia EDIT–301 wykorzystuje ten mechanizm, by zwiększyć produkcję hemoglobiny płodowej (HbF) i tym samym złagodzić objawy anemii sierpowatej i beta-talasemii. W badaniach fazy 1/2 (RUBY i EDITHAL) uzyskano bardzo mocne dane: u 11 pacjentów z anemią sierpowatą po terapii EDIT–301 wszyscy osiągnęli wysoki poziom HbF i żaden nie doświadczył kryzysu naczyniowego [61][62]. Z kolei u 6 pacjentów z beta-talasemią wszyscy przestali wymagać transfuzji krwi [61][62]. Okres obserwacji wynosił minimum 5 miesięcy, a u części dłużej. Nie odnotowano żadnych poważnych zdarzeń niepożądanych związanych z terapią, a profil bezpieczeństwa był porównywalny do exa-cel. FDA przyznała EDIT–301 status leku sierocego oraz przyspieszonej ścieżki RMAT [63]. Jeśli wyniki utrzymają się w większych grupach, Editas może realnie stać się konkurentem CRISPR Therapeutics w chorobach krwi.
Sukces EDIT–301 ma kluczowe znaczenie dla przyszłości firmy. Editas przeszła bowiem znaczącą restrukturyzację: zmieniono CEO, zredukowano kadrę i projekty, aby skoncentrować zasoby na najbardziej perspektywicznych terapiach. Projekty kosztowne i niepewne, jak EDIT–101, odsunięto na dalszy plan. Firma prowadzi także prace w onkologii: we współpracy z Bristol Myers Squibb rozwija edycję limfocytów T, a samodzielnie bada potencjał edycji komórek NK, choć oba te programy są na wczesnym etapie.
Editas posiada unikalne rozwiązania technologiczne w postaci enzymu Cas12a, który jako pierwsi wprowadzili do kliniki [61]. Cas12a tnie DNA w inny sposób niż Cas9 – pozostawia „lepkie końce” i wymaga odmiennego motywu docelowego – co w określonych wskazaniach może być korzystne. Dane z programu EDIT–301 dowodzą, że alternatywna nukleaza działa skutecznie, dzięki czemu Editas dysponuje elastyczniejszą platformą, zdolną do stosowania dwóch różnych enzymów w zależności od potrzeb. Firma ma także solidne portfolio patentów, szczególnie związanych z Broad Institute. Choć spekulacje o czerpaniu przychodów z licencjonowania są dziś mniej aktualne, to przewaga prawna pozwala jej swobodnie używać zarówno Cas9, jak i Cas12a.
Istotnym atutem Editas jest również fakt, że spółka przetrwała trudniejszy okres restrukturyzacji i nadal prowadzi kluczowe badania. Kapitalizacja rynkowa spadła w 2025 r. do ok. 400–500 mln USD, co czyni ją potencjalnym celem przejęcia, ale też sprawia, że ewentualny sukces kliniczny mógłby dać inwestorom znaczący zwrot. Dla spółki wciąż jest więc miejsce w wyścigu, o ile EDIT–301 potwierdzi swoją skuteczność w większych próbach.
Przez lata Editas stopniowo tracił dystans do rywali, a projekty konkurentów przyciągały większą uwagę. Niewystarczająco mocne wyniki w projekcie okulistycznym EDIT–101 spotkały się z krytyką i pokazały, że firma mogła zbyt wcześnie wejść na giełdę bez produktu o wysokim prawdopodobieństwie sukcesu. Obecne kierownictwo postawiło wszystko na EDIT–301. To daje szansę na odbudowę pozycji, ale też oznacza wysokie ryzyko, gdyż każdy problem z bezpieczeństwem czy skutecznością może poważnie zagrozić przyszłości spółki.
W przeciwieństwie do CRISPR Therapeutics, Editas nie ma silnego partnera strategicznego wspierającego rozwój i komercjalizację (sojusz z BMS dotyczy jedynie wczesnej onkologii). Konkurencja jest intensywna, więc Editas musi udowodnić, że potrafi zaoferować coś wyjątkowego. Enzym Cas12a jest przewagą naukową, ale z perspektywy pacjentów i lekarzy kluczowe będą wyniki kliniczne i dostępność terapii.
Finansowo spółka może potrzebować partnera lub dodatkowego kapitału, aby sfinansować kosztowne badania fazy 3. Do tej pory Editas nie zdołał też zbudować tak mocnego wizerunku na rynku jak CRISPR Tx, co przekłada się na mniejsze zaufanie inwestorów. Niemniej, jeśli EDIT–301 dostarczy będzie miało dobre wyniki, firma ma realną szansę powrócić do gry o czołowe miejsce w branży.
Zakończenie cz. I
Editas, Intellia i CRISPR Therapeutics otworzyły erę komercjalizacji edycji genów i pokazały, że CRISPR–Cas9 może być nie tylko przełomem naukowym, lecz także fundamentem nowych modeli biznesowych. Ich szybki rozwój i wejście na giełdę przyciągnęły uwagę całej branży, a wraz z nią setki milionów dolarów finansowania.
To jednak dopiero początek historii. W drugiej części przyjrzymy się kolejnym graczom, którzy dołączyli do wyścigu. Omówimy też najnowsze wyniki badań klinicznych z lat 2023–2025 r. oraz wyzwania, które mogą zdecydować o tym, czy edycja genów stanie się trwałym filarem nowoczesnej medycyny.
🧬
Materiał ma charakter wyłącznie edukacyjny i informacyjny. Nie stanowi rekomendacji inwestycyjnej ani oferty w rozumieniu przepisów prawa. Autor nie ponosi odpowiedzialności za decyzje inwestycyjne podjęte na jego podstawie.
Bibliografia (wybrane źródła):
· U.S. Food and Drug Administration – komunikat prasowy o zatwierdzeniu pierwszej terapii CRISPR (Casgevy) w anemii sierpowatej[2][3].
· Innovative Genomics Institute, “CRISPR Clinical Trials: A 2024 Update” – przegląd aktualnego stanu badań klinicznych CRISPR (m.in. dane o skuteczności w SCD/TDT, ATTR, HAE, CAR-T)[111][48][53][70].
· STAT News, Jason Mast, “The CRISPR companies are not OK” (2025) – analiza wyzwań branży, rozbieżności między przełomami naukowymi a sukcesem finansowym[1][40].
· Nanalyze, “When Will Gene Editing Stocks Finally Take Off?” (2025) – analiza korelacji i wycen spółek edycji genów[109][43].
· Nature News, Heidi Ledford, “World first: ultra-powerful CRISPR treatment trialled in a person” (2025) – opis pierwszego użycia prime editing u pacjenta[10][9].
· The Guardian, Ian Sample, “Chinese scientist who edited babies’ genes jailed for three years” (2019) – o sprawie He Jiankui i konsekwencjach etycznych[12][11].
· Fierce Biotech, James Waldron, “Graphite’s hopes for sickle cell ‘cure’ blunted after first patient dosed experiences serious event” (2023) – raport o przerwaniu trialu Graphite Bio z powodu efektu niepożądanego[103].
· U.S. FDA – informacja o wskazaniach i mechanizmie działania Casgevy oraz równocześnie zatwierdzonej terapii lentiwirusowej (Lyfnejina)[2][3].
(Wszystkie powyższe źródła są anglojęzycznymi publikacjami wysokiej renomy, zawierającymi aktualne dane naukowe i finansowe zgodne ze stanem wiedzy na sierpień 2025.)
[1] [40] [59] The CRISPR gene editing revolution loses its mojo | STAT https://www.statnews.com/2025/02/06/crispr-gene-editing-medical-breakthrough-not-matched-by-financial-success/
[2] [3] [4] [5] [18] FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease | FDA https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease
[6] [7] CRISPR Illustration | National Institute of General Medical Sciences https://nigms.nih.gov/image-gallery/7036
[8] [13] [14] [15] [16] [17] [19] [20] [21] [22] [23] [24] [25] [26] [27] [28] [29] [30] [31] [32] [33] [34] [35] [36][37][38] [39] [41] [44] [45] [46] [47] [48] [49] [50] [51] [52] [53] [54] [55] [56] [57] [58] [61] [62] [63] [64] [65][66] [67][68] [69] [70] [71] [72] [73] [74] [75] [76] [77] [78] [80] [81] [82] [83] [84] [85] [86] [87] [88] [89] [90][91] [92] [93][94] [95] [96] [97] [98] [99] [100] [101] [102] [107] [108] [110] [111] CRISPR Clinical Trials: A 2024 Update - Innovative Genomics Institute (IGI) https://innovativegenomics.org/news/crispr-clinical-trials-2024/
[9] [10] World first: ultra-powerful CRISPR treatment trialled in a person https://www.nature.com/articles/d41586-025-01593-z?error=cookies_not_supported&code=7946d89d-2c38-40ac-bb64-c8ef711bf423
[11] [12] Chinese scientist who edited babies’ genes jailed for three years | China | The Guardian https://www.theguardian.com/world/2019/dec/30/gene-editing-chinese-scientist-he-jiankui-jailed-three-years
[42] [43] [79] [109] When Will Gene Editing Stocks Finally Take Off? - Nanalyze https://www.nanalyze.com/2025/07/when-will-gene-editing-stocks-finally-take-off/
[60] Editas, changing course again, looks to partner lead CRISPR therapy https://www.biopharmadive.com/news/editas-reni-cel-partner-research-pivot-in-vivo-gene-editing/730530/
[103] [104] [105] [106] Graphite halts sickle cell trial over effect on first patient https://www.fiercebiotech.com/biotech/graphites-hopes-sickle-cell-cure-blunted-after-first-patient-dosed-experiences-serious
[110] Allogene Therapeutics Presents Updated ALLO-501/501A Phase 1 Data in Large B Cell Lymphoma at the American Society of Clinical Oncology (ASCO) Annual Meeting https://ir.allogene.com/news-releases/news-release-details/allogene-therapeutics-presents-updated-allo-501501a-phase-1-data
[111] Exploring the role of the combination of FDG PET plus whole body MRI for staging newly diagnosed and relapsed/refractory multiple myeloma: A prospective trial. https://ascopubs.org/doi/abs/10.1200/JCO.2024.42.16_suppl.7512
[112] Caribou Biosciences Reports Second Quarter 2025 Financial Results and Provides Business Update https://investor.cariboubio.com/news-releases/news-release-details/caribou-biosciences-reports-second-quarter-2025-financial
[113] Caribou Biosciences – Pipeline Prioritization https://investor.cariboubio.com/news-releases/news-release-details/caribou-biosciences-announces-strategic-pipeline-prioritization?utm_source=chatgpt.com
[114] ASCO 2024 – CB-010 (ANTLER trial, HLA matching PFS 14.4 vs 2.8 mies.). https://ascopubs.org/doi/abs/10.1200/JCO.2024.42.16_suppl.7512
[115] Caribou Biosciences. Second Quarter 2025 Financial Results. Company 10-Q, sierpień 2025. https://investor.cariboubio.com/news-releases/news-release-details/caribou-biosciences-reports-second-quarter-2025-financial
[116] FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease - https://www.fda.gov/news-events/press-announcements/fda-approves-first-gene-therapies-treat-patients-sickle-cell-disease?utm_source=chatgpt.com
[117] prime medicine announces breakthrough clinical data showing rapid restoration of dhr positivity after single infusion of pm359, an investigational prime editor for chronic granulomatous disease https://investors.primemedicine.com/news-releases/news-release-details/prime-medicine-announces-breakthrough-clinical-data-showing?utm_source=chatgpt.com







